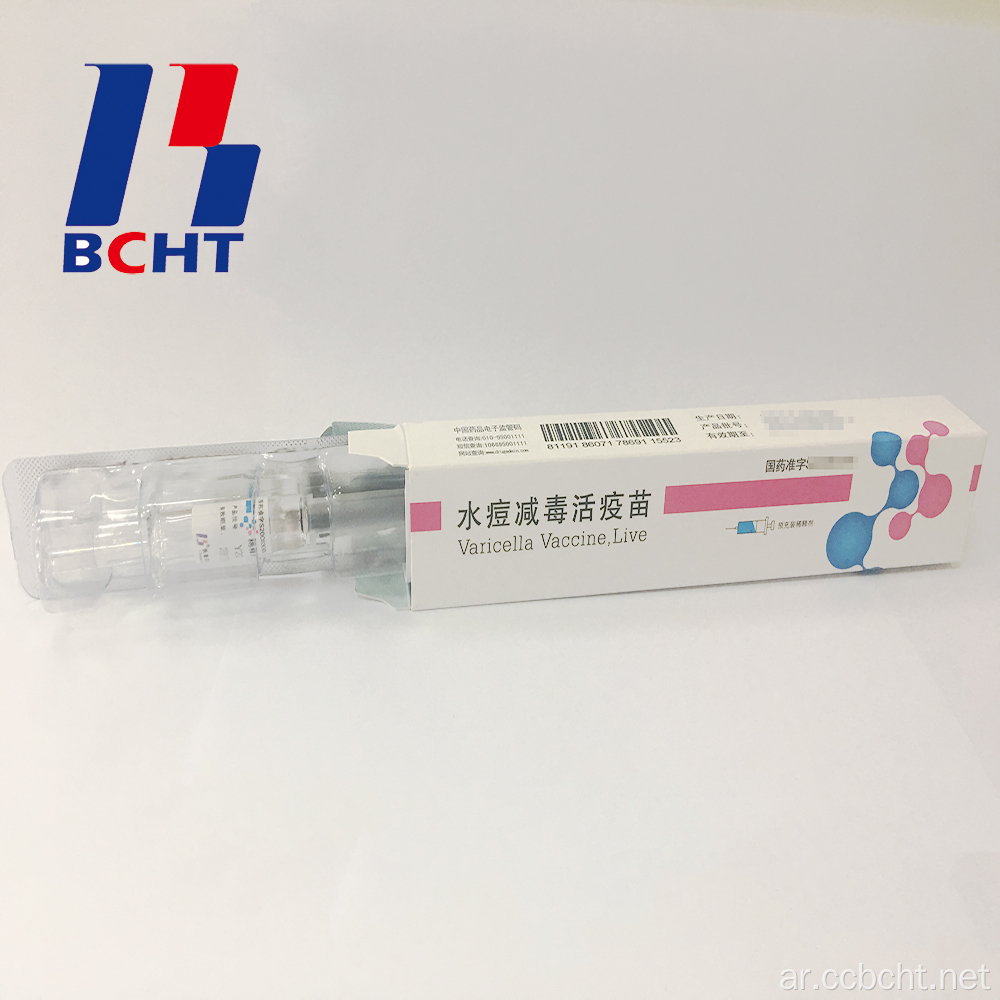
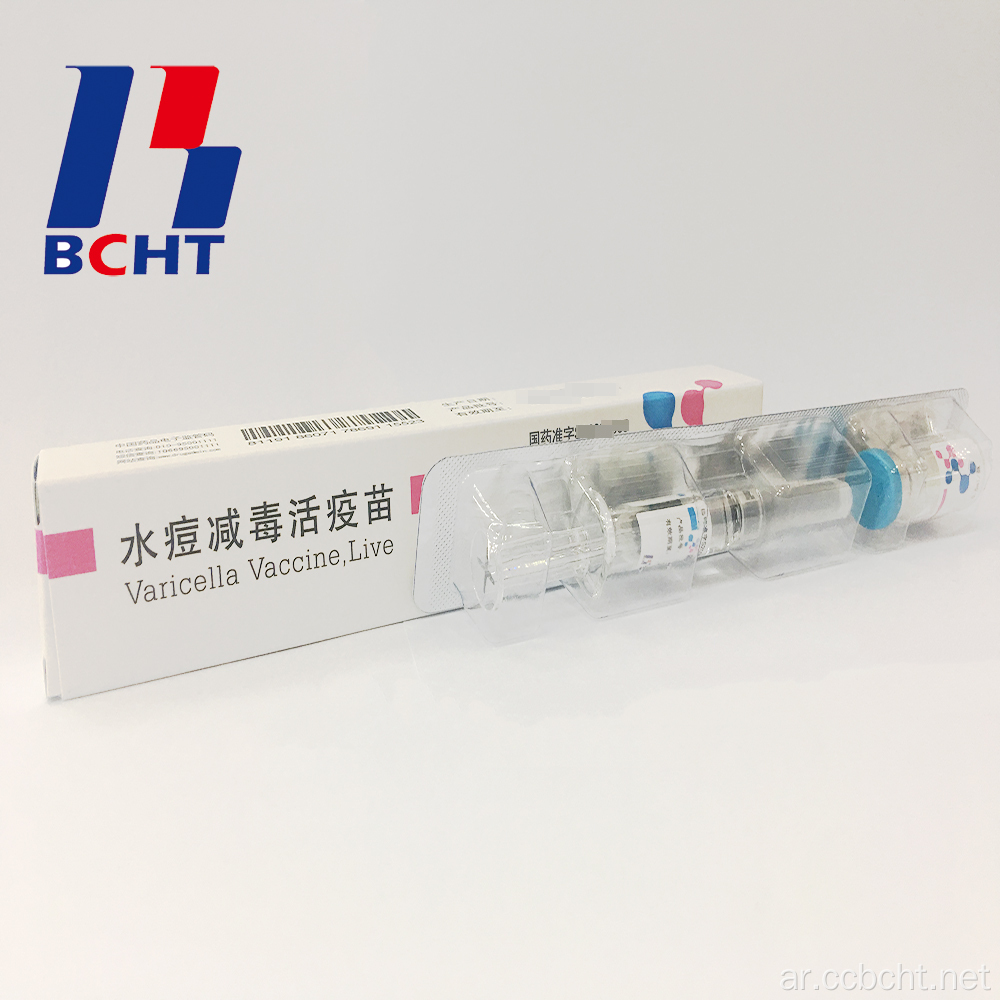
( 0 )سلة الاستفسارات
( 0 )سلة الاستفسارات - English
- Español
- Português
- Pусский
- Français
- Deutsch
- 日本語
- 한국어
- العربية
- Italiano
- Nederlands
- ελληνικά
- Svenska
- Polski
- ภาษาไทย
- Türk
- हिंदी
- Indonesia
- Melayu
- Việt
- dansk
- Magyar
- Қазақша
- বাঙালি
- עִברִית
- čeština
- Somali
- မြန်မာ
- فارسی
- Українська
- norsk
- Gaeilge
- беларускі
- ລາວ
- Filipino
- O'zbek
- اردو
- Ibo
- Zulu
- Кыргызча
- Тоҷикӣ
- नेपाली
- Kurdî
- Kiswahili
- ქართული
- Yorùbá
- Монгол
- Hausa
- Azərbaycanca
- ខ្មែរ





 مسح لزيارة
مسح لزيارة